[最も選択された] 質量 パーセント 濃度 問題 応用 594773-質量 パーセント 濃度 問題 応用
質量パーセント濃度の求め方!「溶液」「溶質」「溶媒」の理解が勉強のポイント! 質量パーセント濃度 計算問題 study005netcom;至急理科の質量パーセント濃度の応用について 至急理科の質量パーセント濃度の応用について以下の問題の解き方お願いします。 次のA&#;Dのような食塩水をつくった。 A:50gの水に10gの食塩を溶かした。 B:100gの水に25gの食塩を溶かした。優れた 質量 パーセント 濃度 問題 応用 危険物資格取得のための高校化学no 1 濃度計算 F Z Theory 中1理科 濃度の計算特訓 混ぜ合わせの濃度計算まで 濃度の応用 応用編 質量 濃度を完全に操り 化学者の素質を磨け Menon Network 化学基礎の質量パーセント濃度

モル濃度計算の解き方 公式 希釈時の濃度 密度や質量パーセント濃度との変換など 化学のグルメ
質量 パーセント 濃度 問題 応用
質量 パーセント 濃度 問題 応用-質量パーセント濃度の応用問題の解き方 公式をもう一度確認しておきましょう。溶液には溶かした物質が同じものでも、濃度によってちがうものになります。 例えば、同じ塩水でも薄い塩水と濃い塩水がありますよね。 この溶液の濃さを表すときに使わ質量 パーセント 濃度 問題 応用 モル濃度計算を攻略 公式 希釈時の濃度 密度や質量パーセント濃度との変換など 化学のグルメ 溶液の濃度 無料で使える中学学習プリント 中学1年生 理科 水溶液の性質 練習問題プリント 無料ダウンロード 印刷 ちびむすドリル 中学生 質量パーセント濃度の応用問題です 見づらくてすみませんこの 3 の求 Yahoo 知恵袋 これで理科
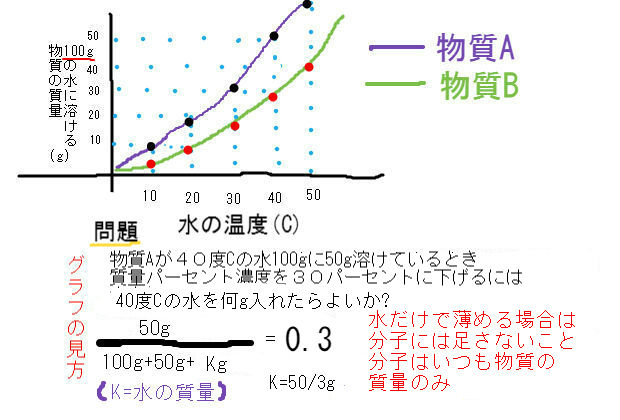



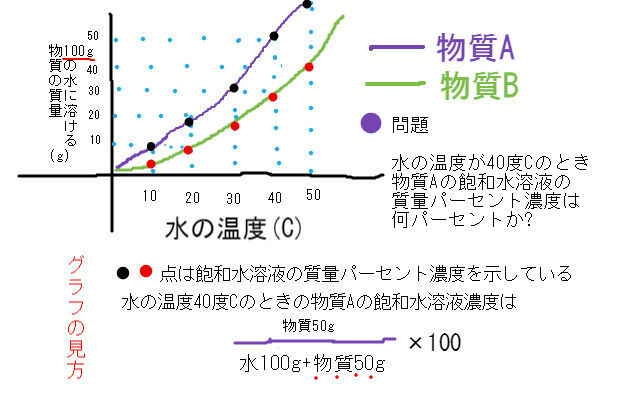
グラフを使った水溶液濃度の問題 中学数学 理科 寺子屋塾の復習サイト
7 100 = 7 100 x計算問題 質量パーセント濃度1 質量パーセント濃度2 質量パーセント濃度3 質量パーセント濃度4 質量パーセント濃度5 質量パーセント濃度6 質量パーセント濃度7 溶解度1 溶解度2 溶解度3 溶解度4 密度 密度2 密度3 チェックテスト問題(2学期期末) 質量パーセント濃度が10%の食塩水 500gと,2%の食塩水100gを混ぜ合わ せたときにできる食塩水の質量パーセン ト濃度は何%になるか。小数第2位を四 捨五入して求めよ。
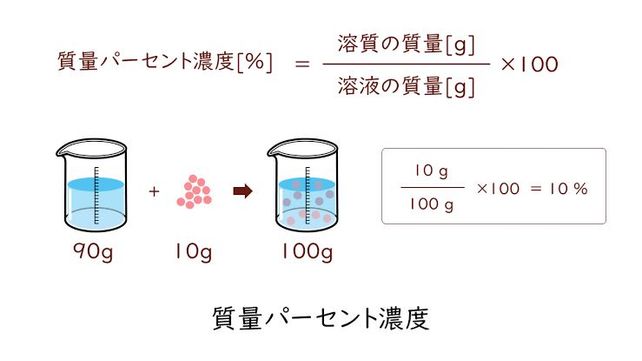
また、これらの計算問題を解くためには、腎臓の基礎知識、濃度 質量パーセント濃度の応用問題の解き方 hiho 質量パーセント濃度の応用問題の解き方 公式をもう一度確認しておきましょう。 例題3 濃度6%の食塩水150gに水を50g加えてうすめた。質量パーセント濃度とは 次は"質量パーセント濃度"にうつりましょう。 単位:g/g→% $$\frac{溶質の質量(g)}{溶液の質量(g)}\times 100=\%$$ これも非常に単純で、溶液の質量(g)を分母、溶質の質量(g)を分子に持って来た上で「割合」を求めます。水溶液の濃度 名前 溶液の濃さを、溶質の質量が全体の質量の何%にあたるかで表したものを 何というか。 次の問いに答えなさい。 ① 水 g に食塩 gをまぜると、何%の食塩水になるか。 ② 水 g に砂糖が gとけている。この砂糖水溶液の質量パーセント濃度
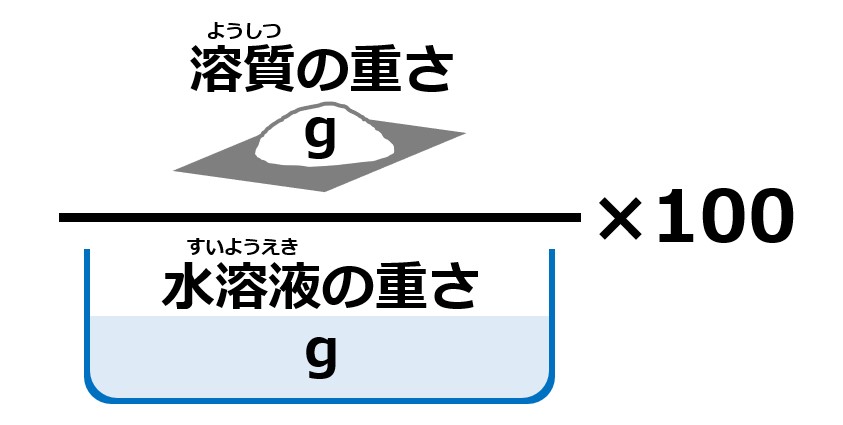
質量パーセント濃度=溶質÷溶液×100 となります! 後ろに100を掛けているのは、出てきた値を百分率で表したいからです。 なので、出てきた値に必ず%をつけましょう! また、溶液は溶質と溶媒の量はを合わせた量に等しいので、 質量パーセント濃度=溶質÷解答:100g 12. 食塩15gと水285gを混ぜ、火にかけていきました。 (1)すべて混ざり合うと濃さは何%ですか。 (2)火をかけ続け、水が何gか蒸発したので、濃さを調べたところ、10%でした。 水は何g蒸発しましたか。 解説: (1)食塩水の公式から 15÷(15+285)=005→5%。質量パーセント濃度の計算問題集応用編 水溶液の濃度を世界で統一した質量パーセント濃度と、その基本練習は終わりましたね。 質量パーセント濃度の計算問題集基本編 科学者たちは、質量パーセント濃度という基準をつくり、世界を発展させたことは学びましたよね。 具体的にいえば、「この溶液が100gあったとき、溶質は何gあるのか? 」を示す指標




質量パーセント濃度の求め方 問題を使ってかんたんに解説するぞ 中学数学 理科の学習まとめサイト




食塩水の問題とは 濃度の計算公式や連立方程式を用いた解き方を解説 小学生も必見 遊ぶ数学
X 100 =3x ③ x×質量パーセント濃度の求め方 中学で学習するのは 質量パーセント濃度 を求めることです。 濃度とは 溶液の中に溶けている溶質の割合 を求めることです。 →割合をパーセントで表ます。 小学校の割合を%で表すあたりで自信がない場合は小学校の割合の問題を復習しましょう。 溶液や溶質の単位は 質量(g) で表しますので、質量パーセントということです。しておくと,水溶液の濃度 のうど はし だいに全体的に均一になっていく。水溶液は,いったん均一になると,逆戻りすることはな い。したがって,ふたたび,底の方の濃度が濃くなったりすることはない。 問題(2 学期期末)



1




濃度のはなし 中学生向け 質量パーセント濃度について 学習内容解説ブログ
まとめ:質量パーセント濃度の公式は使う前の整理が大事! 質量パーセント濃度の求め方の公式は、 (質量パーセント濃度 % )= (溶質の質量)÷(溶液の質量)×100 だったね?? 質量パーセント濃度の問題をクリアするコツとしては、質量パーセント濃度の計算問題集応用編 Menon Network 質量パーセント濃度16%の塩酸が450gであるから、以下の計算で求めることができます。 質量パーセント濃度16%の塩酸450gには、72gの塩化水素が溶けていることが分かります。質量パーセント濃度の応用問題の解き方 公式をもう一度確認しておきましょう。 例題3 濃度 6% の食塩水 150g に 水を50g 加えてうすめた。




質量パーセント濃度の計算問題集 応用編 Menon Network



Mol濃度 質量パーセント濃度 質量モル濃度の相互変換の仕方のコツ
質量パーセント濃度の求め方 問題を使ってかんたんに解説するぞ 中1理科 濃度の計算特訓 混ぜ合わせの濃度計算まで 理科 中1 27 質量パーセント濃度 Youtube 3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを Akiya Su En Twitter 理科 質量質量パーセント濃度 水溶液の質量に対する溶質の質量の比を水溶液の濃度といい、濃度を百分率(%)で表したものを質量パ-セント濃度といいます。 <求め方> (※水溶液=水+溶質) 溶解度と質量パーセント濃度の練習問題 問題1 まずは、一問一答質量パーセント濃度の計算問題集応用編 Menon Network 質量パーセント濃度基準を統一する科学者たち 質量パーセント濃度の計算問題集基本編 この回の問題は最初、まず問題だけを読んで自分でチャレンジしてましょう。




4 6 溶液の濃度 おのれー Note
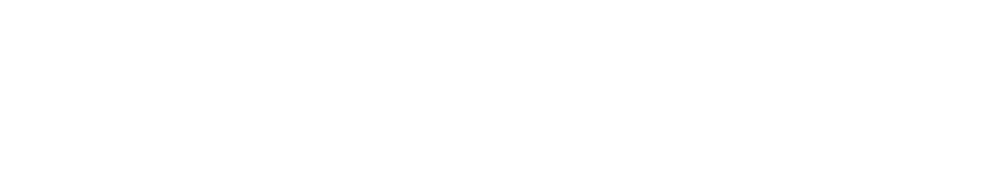



モル濃度計算の解き方 公式 希釈時の濃度 密度や質量パーセント濃度との変換など 化学のグルメ
9:濃度 溶液の濃さについて学習します。 水溶液をつくった。 この塩化ナトリウム水溶液の質量パーセント濃度は何%か。 ※無料講座の続きは、有料講座のタブでご確認できます。 応用問題の解答は、応用問題のタブでご確認できます。練習問題1「溶液の重さがわかってるパターン」 水と砂糖を混ぜてコップ一杯分の砂糖水0gを作ってみました。 8gのシュガースティックで砂糖を混ぜたとすると、この砂糖水の質量パーセント濃度はいくつになりますか? この問題は質量パーセント濃度の公式を使うだけ。 溶質(砂糖)の質量 :8g 溶液(砂糖水)の質量:0g (質量パーセント濃度 % )= (溶質X 100 =2x 10%の食塩水300gに含まれる食塩は 300×



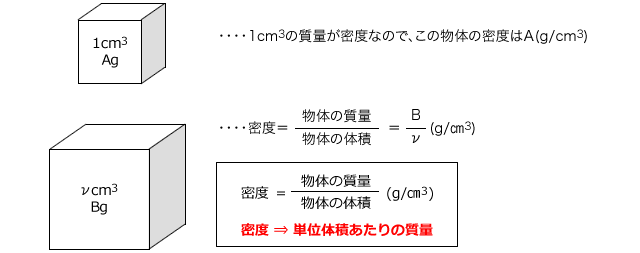
化学講座 第12回 密度と濃度医学部受験を決めたら 私立 国公立大学医学部に入ろう ドットコム



こうすれば解ける 食塩水の問題 方程式の具体例
10 100 =30 0gと300gを混ぜるのでできた8%の食塩(上の2つの問題の解答は一番下です。) さて、今回は質量パーセント濃度のお話をしました。 実はこの質量パーセント濃度の問題は、 数学の方程式でも取り扱われる内容なのでこの公式は要チェックです。 次回は高校生向けの濃度のお話です。お楽しみに‼答 1 (1)答8% 解説 質量パーセント濃度 = 溶質 (g) 溶液 (g) ×100より 250 ×100=8 (2)答 250g % 解説 ① 砂糖水 (溶液) = 砂糖 (溶質)水 (溶媒) より 500=250 ② 質量パーセント濃度 = 溶質 (g) 溶液 (g) ×100より 50 250 ×100= (3)答375% 解説 砂糖水 (溶液) = 砂糖 (溶質)水 (溶媒) より 砂糖水の質量は=160g




質量 パーセント 濃度 計算 風人




質量パーセント濃度の求め方 問題を使ってかんたんに解説するぞ 中学数学 理科の学習まとめサイト
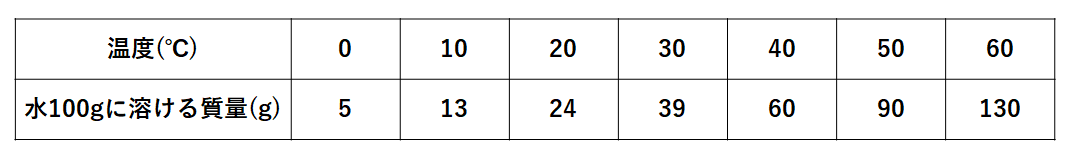
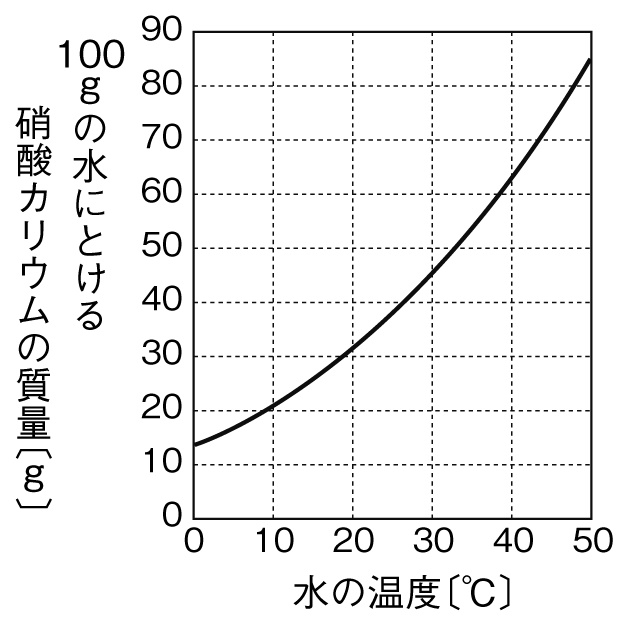
100 答えは 5% となります 質量濃度(質量体積パーセント 濃度)( mass concentration )とは,質量を混合物の体積 しかし、問題を次のように一般化し、落ち質量パーセント濃度の計算問題集基本編 科学者たちは、質量パーセント濃度という基準をつくり、世界を発展させたことは学びましたよね。 具体的にいえば、 「この溶液が100gあったとき、溶質は何gあるのか? 」 を示す指標です。 質量パーセント濃度基準を統一する科学者たち 水溶液には、溶質と溶媒があります。 溶媒が水であれば、水溶液とよぶ濃度%の水溶液800g 160g 濃度15%の水溶液600g 90g 表を見て次の問いに答えよ。 水100gに溶ける質量 水の温度 (℃) 0 40 60 硝酸カリウム (g) 133 316 639 1092 40℃での飽和水溶液の質量パーセント濃度を求めよ。 (割り切れない場合小数第2位で四捨五入) 39% 60℃の水100gに硝酸カリウム70gを溶かして、その水溶液を0℃まで冷やすと何g再結晶するか。



5 56 oog B1oog See How To Solve It At Qanda
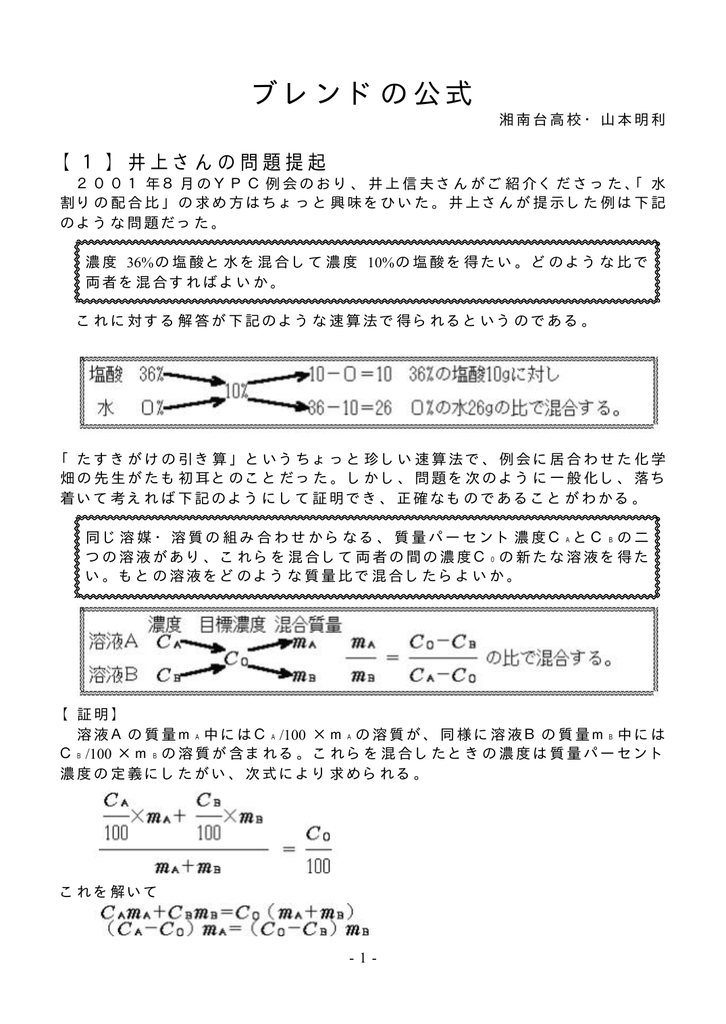



ブレンドの公式 Pdfファイル538kb
一般的に使っている濃度とは「質量パーセント濃度」のことです。 体積など関係なく質量だけの割合ですので難しく考えなくて良いですよ。 濃度の違う食塩水を混ぜるときのポイント 先に問題をあげて100 なので、 (g) ÷質量パーセント濃度の応用問題の解き方 公式をもう一度確認しておき 中学1年理科。質量パーセント濃度の計算特訓を行います。 レベル 重要度 ポイント:食塩(溶質)の量に注目問題のダウンロードはこ




34 Descubre Como Resolverlo En Qanda




モル濃度とパーセント濃度を脳みそを使わず変換する計算法 化学受験テクニック塾
問題を解くことができません。詳しく教えてください。できれば早めにお願いします。 問題1 質量パーセント濃度%の塩化ナトリウム水溶液に80 gの水を加えたところ、12%の水溶液になった。はじめの水8 100 =16 ② 300×こんにちは、ウチダショウマです。 今日は、小学生中学生共に苦手意識を感じやすい 「食塩水の問題」 について、主に濃度(のうど)を求める計算公式を解説していきたいと思います。 また、中学生になると「連立方程式」を用いる問題が増えてきますので、それについては記事の後半で




高校化学基礎 質量パーセント濃度とは 映像授業のtry It トライイット



Www Pref Saitama Lg Jp Documents 30rika Pdf
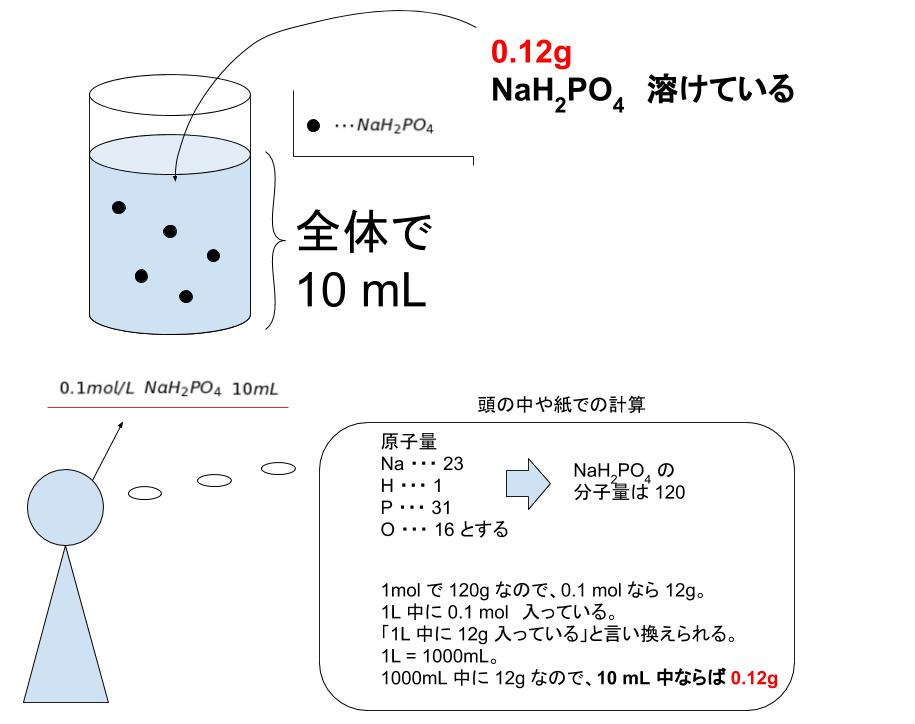
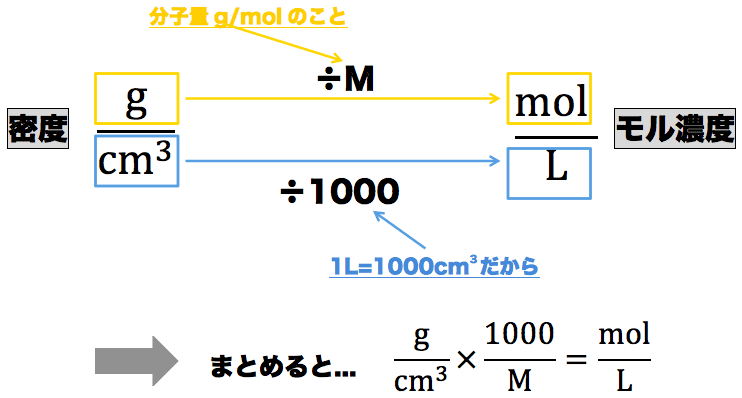
連立の計算問題 基礎から標準問題までの練習問題と、例題による解き方の説明 はじめにあった0gの食塩水の濃度をx%とする。 x%の食塩水0gに含まれる食塩は 0×濃度の変換問題は,質量パーセント濃度% ⇔ モル濃度mol/L の変換が頻出となる。 Ⅰ質量パーセント濃度に関する問題タイプ Ⅱモル濃度に関する問題タイプ ・質量パーセント濃度:溶液中に溶けている溶質の質量を百分率で表した濃度。溶液100gあたりのまずは、問題文を読んでいきます。 問題文で何が与えられているか、最終的に何を求めるのかを読み取るのが重要です。 質量パーセント濃度が 22% 、密度が 12g/mL の水酸化ナトリウム水溶液があります。 この水溶液の モル濃度 を求めていきましょう。




食塩水問題 濃度算 の2つの解き方とポイントを図で解説 数学fun



Thinkstock Images
濃度 100 = 含まれる食塩の質量 準備 (1)次の食塩水に含まれている食塩の質量を求めよ。 ① 8%の食塩水0g ② x%の食塩水300g ③ 7%の食塩水xg (2) 3%の食塩水0gに8%の食塩水300gを加えてよくかき混ぜたら何%の食塩水ができるか。 (1)上記の公式を使う ① 0×



Q Tbn And9gcsb1uq7n3ghpdmmm6bnifzarmojtjzs00fu7ldneg50py0pkw Usqp Cau




濃度のはなし 中学生向け 質量パーセント濃度について 学習内容解説ブログ



Www Pref Saitama Lg Jp Documents 30rika Pdf



1




4 6 溶液の濃度 おのれー Note




4 6 溶液の濃度 おのれー Note




高校生物基礎 腎臓のイヌリン濃縮率や原尿量などの計算問題の解き方 高校生物の学び舎




進むか教育劣化 ついに登場 が理解できない大学生 3ページ目 日経ビジネス電子版




質量パーセント濃度の計算問題集 基本編 Menon Network




質量パーセント濃度の求め方 問題を使ってかんたんに解説するぞ 中学数学 理科の学習まとめサイト




質量パーセント濃度 中学生 理科のノート Clear




化学基礎ワークの応用例題16番 1 を教えてください 問題文の回答を読 化学 教えて Goo



化学 解決済みの質問 Yahoo 知恵袋



グラフを使った水溶液濃度の問題 中学数学 理科 寺子屋塾の復習サイト




高校化学基礎 濃度の計算 練習編 映像授業のtry It トライイット




質量パーセント濃度の求め方 問題を使ってかんたんに解説するぞ 中学数学 理科の学習まとめサイト




中学1年生 理科 水溶液の性質 練習問題プリント 無料ダウンロード 印刷 ちびむすドリル 中学生




5 56 oog B1oog See How To Solve It At Qanda




11 X 1 Db Ex 13 11 See How To Solve It At Qanda




中1理科基本問題集 単元2物質のすがた 化学分野
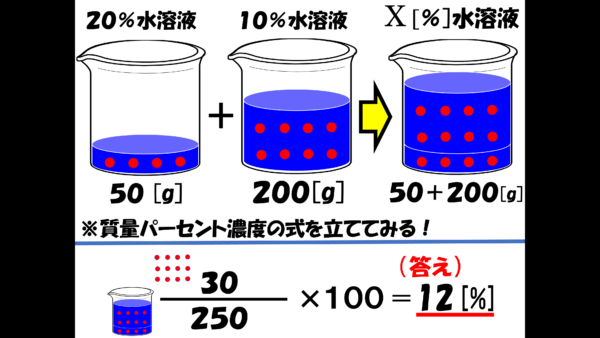



危険物資格取得のための高校化学no 2 濃度計算 F M サイエンスブログ




中1理科 数学 食塩水の問題を動画でマスター 公式の覚え方と濃度の計算 マナブレイン




質量パーセント濃度の計算問題集 応用編 Menon Network
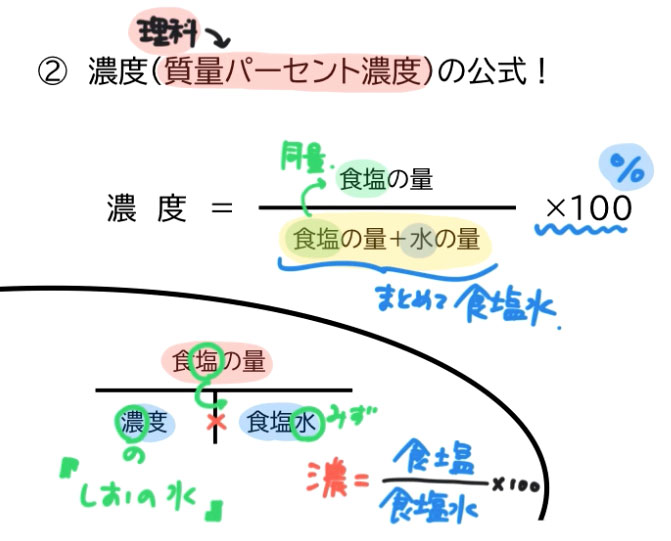



中1理科 数学 食塩水の問題を動画でマスター 公式の覚え方と濃度の計算 マナブレイン




モル濃度計算の解き方 公式 希釈時の濃度 密度や質量パーセント濃度との変換など 化学のグルメ




化学基礎 濃硫酸のモル濃度を求める問題 オンラインプロ家庭教師 理数ゼミ



中1化学 溶解度の計算問題 中学理科 ポイントまとめと整理




Images Of 溶質 Japaneseclass Jp



こうすれば解ける 食塩水の問題 方程式の具体例



溶液の濃度計算 薬学 これでok



飽和食塩水 濃度 求め方




理科 濃度の計算 問題つき 中学生 理科のノート Clear




中1 水溶液 中学生 理科のノート Clear




濃度のはなし 中学生向け 質量パーセント濃度について 学習内容解説ブログ



グラフを使った水溶液濃度の問題 中学数学 理科 寺子屋塾の復習サイト



攻略 一次方程式の文章問題 濃度を例に解説 中学数学 理科も




質量パーセント濃度の求め方 問題を使ってかんたんに解説するぞ 中学数学 理科の学習まとめサイト




G Hc Naohnaoh X1 Descubre Como Resolverlo En Qanda




モル濃度とパーセント濃度を脳みそを使わず変換する計算法 化学受験テクニック塾
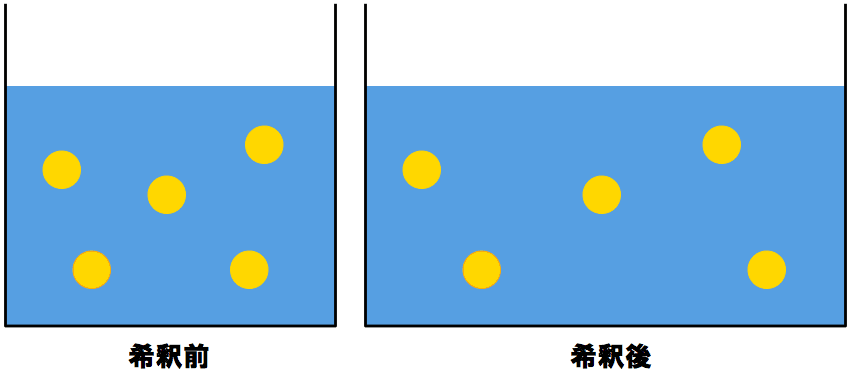



モル濃度計算の解き方 公式 希釈時の濃度 密度や質量パーセント濃度との変換など 化学のグルメ



質量パーセント濃度 ネット塾




腎臓 計算に必要な基礎知識 濃縮率の求め方 せいぶつ農国




中学数学の2種類の濃度の食塩水を混ぜる問題 その7 Makelemonadejp Com
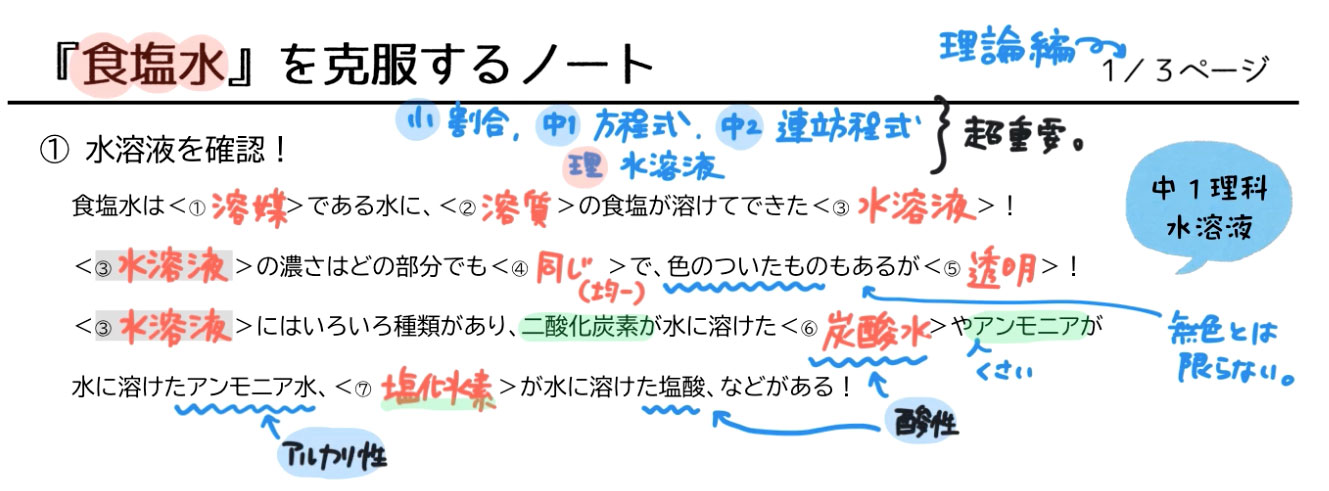



中1理科 数学 食塩水の問題を動画でマスター 公式の覚え方と濃度の計算 マナブレイン
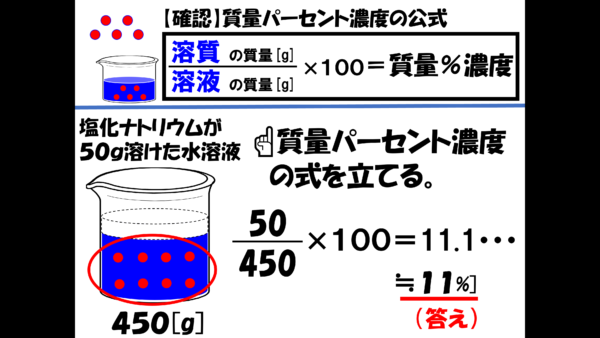



危険物資格取得のための高校化学no 2 濃度計算 F M サイエンスブログ




理科 濃度の計算 問題つき 中学生 理科のノート Clear




高校化学基礎 濃度の計算 練習編 映像授業のtry It トライイット



定期テスト対策問題 質量パーセント濃度の計算演習問題 Examee




モル濃度とは 計算 求め方 公式はコレで完璧 質量パーセントとの違いも 高校生向け受験応援メディア 受験のミカタ




これで理科マスター 質量パーセント濃度を計算する5つの問題 Qikeru 学びを楽しくわかりやすく



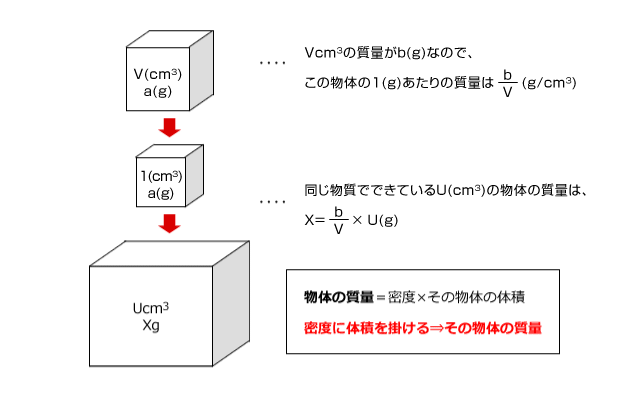
化学講座 第12回 濃度と密度 私立 国公立大学医学部に入ろう ドットコム



1




これで理科マスター 質量パーセント濃度を計算する5つの問題 Qikeru 学びを楽しくわかりやすく




これで理科マスター 質量パーセント濃度を計算する5つの問題 Qikeru 学びを楽しくわかりやすく



モル濃度計算の解き方 公式 希釈時の濃度 密度や質量パーセント濃度との変換など 化学のグルメ




中学理科 計算問題 質量パーセント濃度の計算 Youtube




34 Descubre Como Resolverlo En Qanda




食塩水の問題とは 濃度の計算公式や連立方程式を用いた解き方を解説 小学生も必見 遊ぶ数学




質量パーセント濃度の計算問題集 応用編 Menon Network




化学基礎演習 神奈川工科大学工学部応用化学科




溶液の質量パーセント濃度の求め方と比重を利用した計算問題



高校の化学基礎です 質量パーセント濃度のところなんですが 分からないので画 Yahoo 知恵袋



これで理科マスター 質量パーセント濃度を計算する5つの問題 Qikeru 学びを楽しくわかりやすく




1 3教えて下さい 試験が近いので早めの解答をお願いしたいです Clear




エレガント質量 パーセント 濃度 最高のぬりえ




4 6 溶液の濃度 おのれー Note




算数 食塩水の文章問題の解き方の解説 2 濃度比と質量比の関係を使って解く問題 算数 数学 の文章題 特殊算など のことを書くページ




理科 質量パーセント濃度まとめ 中学生 理科のノート Clear




中学1年生 理科 水溶液の性質 練習問題プリント 無料ダウンロード 印刷 ちびむすドリル 中学生




グラフを使った水溶液濃度の問題 中学数学 理科 寺子屋塾の復習サイト
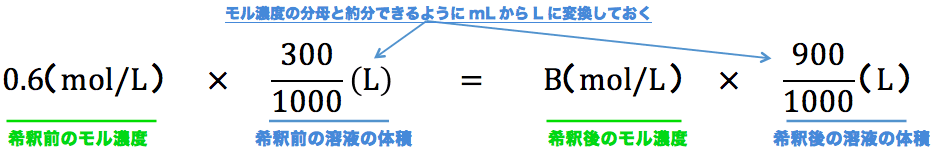



モル濃度計算の解き方 公式 希釈時の濃度 密度や質量パーセント濃度との変換など 化学のグルメ




中学1年生 理科 水溶液の性質 練習問題プリント 無料ダウンロード 印刷 ちびむすドリル 中学生




質量パーセント濃度 Japaneseclass Jp




Determining The Mass Percent Composition In An Aqueous Solution Protocol Translated To Japanese
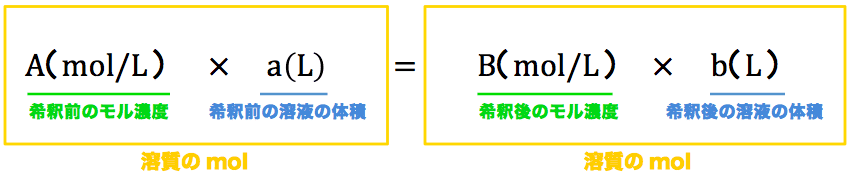



モル濃度計算の解き方 公式 希釈時の濃度 密度や質量パーセント濃度との変換など 化学のグルメ




中学1年生 理科 水溶液の性質 練習問題プリント 無料ダウンロード 印刷 ちびむすドリル 中学生




2 と 3 の解き方が答えを見てもわからないので教えていただきたいです Clear
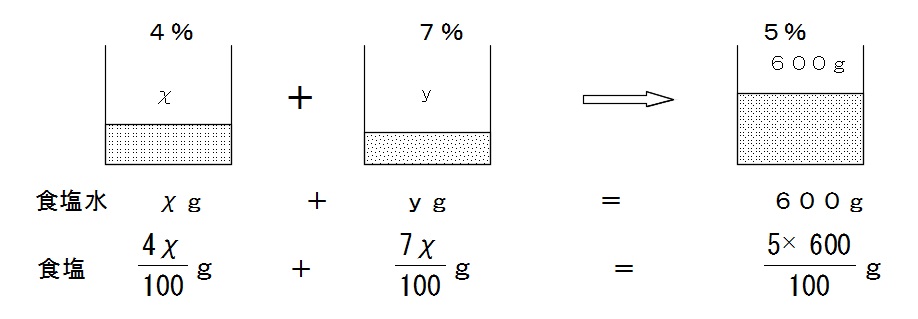



連立方程式 食塩水の濃度と食塩水を混ぜる文章問題の立式方法と解き方




高校化学基礎 密度とモル濃度 映像授業のtry It トライイット




4 6 溶液の濃度 おのれー Note




蒸発させる 中学受験の基礎知識 濃度 Youtube




これで理科マスター 質量パーセント濃度を計算する5つの問題 Qikeru 学びを楽しくわかりやすく



化学基礎モル濃度の計算問題です 類題3 1 質量パーセント濃度が Yahoo 知恵袋



Www Pref Saitama Lg Jp Documents 30rika Pdf
コメント
コメントを投稿